LOS CAMBIOS DE ESTADO DE LA MATERIA
“El té aviva nuestra imaginación. Reprime los vapores que invaden la cabeza y mantiene sereno el palacio del alma”
Edmund Waller
¿En cuántas formas diferentes puede existir una misma sustancia?
Los tres estados clásicos en los que puede existir una sustancia sonsólido, líquido y gaseoso, y esto está influenciado por la temperatura y presión a la cual se encuentra sometida dicha sustancia, que determinan la organización de las moléculas que conforman la misma.
Veamos un ejemplo típico…
Quizás el ejemplo más utilizado para explicar los cambios de estado de la materia sea el agua.
· El estado más usual en el que podemos encontrar este compuesto es el estado líquido, en donde el agua se comporta como un fluido, adoptando, por lo general, la forma del recipiente que lo contiene. El agua contenida en un vaso, en una pileta de natación o en una laguna se encuentra en estado líquido.
· Cuando colocamos agua en un recipiente o en una cubetera y la exponemos por un par de horas a temperaturas por debajo de los 0°C, vamos a ver cómo el agua se solidifica, adquiriendo una estructura rígida y compacta. Esta situación es la que se conoce como estado sólido del agua.
· Finalmente, cuando colocamos agua líquida en una pava o en una olla de cocina y aplicamos calefacción, vemos como, al cabo de unos minutos, se empiezan a generar vapores, constituyendo el estado gaseoso del agua.
¿Cómo podemos explicar lo anterior?
La materia está constituida por átomos y estos átomos se agrupan entre sí formando moléculas. A estos átomos o moléculas se los puede llamar de manera genérica como partículas, que interactúan entre sí mediante la generación de fuerzas de atracción o de cohesión.
· En el estado sólido, las fuerzas de atracción entre partículas son muy grandes. Debido a esto esto, las partículas están muy próximas entre sí, se agrupan de manera ordenada y casi no se mueven, solamente vibran en posiciones fijas. Esto explica el hecho de que los sólidos tengan forma y volumen propios.
· En el estado líquido, las fuerzas de atracción entre partículas son menores que en los sólidos, y las partículas ruedan unas sobre otras. Esto explica por qué los líquidos tienen volumen, pero no forma propia, y permite comprender por qué fluyen, es decir, se derraman.
· En el estado gaseoso, las fuerzas de atracción son muy pequeñas, por ello las partículas se mueven a mucha velocidad y se alejan entre sí. El movimiento es desorganizado y debido a esto, los gases no tienen forma ni volumen definidos.
Los tres estados de la materia pueden interconvertirse entre sí sin que cambie la composición de una sustancia, y estos cambios de estado se ven influenciados por factores ambientales como temperatura y presión. La Figura 1 representa los diferentes cambios de estado de la materia.
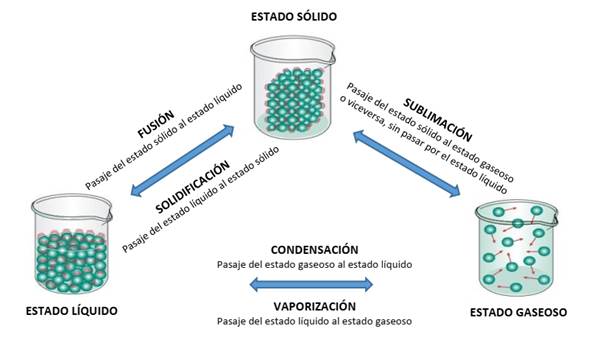
Figura 1: Cambios de estado de la materia
¿Qué es la sublimación?
La sublimación es un proceso que implica el pasaje de una sustancia del estado sólido al estado gaseoso, o del estado gaseoso al estado sólido, sin pasar por el estado líquido. Es decir, bajo determinadas condiciones de temperatura y de presión, podemos lograr que ciertas sustancias puedan transformarse directamente de sólidas a gaseosas (y viceversa) sin pasar al estado fundido.
¿Qué aplicaciones tiene la sublimación?
Si bien son muy pocas las sustancias que pueden sublimar a presión atmosférica, la sublimación puede aplicarse en un laboratorio como una técnica de purificación de sólidos muy eficaz, aunque los rendimientos obtenidos en este procedimiento suelen ser bastante bajos. El naftaleno, presente en las bolas comerciales de naftalina utilizadas para ahuyentar polillas, o el alcanfor, sustancia cristalina de olor fuerte y penetrante, y que puede emplearse en la elaboración de pomadas con fines analgésicos para músculos y articulaciones, son algunos ejemplos de sustancias sublimables en condiciones ambientales. La cafeína, probablemente el estimulante más antiguamente utilizado por el hombre, también puede purificarse por esta técnica.
¿Qué es la cafeína?
La cafeína (Figura 2) es un compuesto orgánico que puede clasificarse como un alcaloide y que ejerce una acción estimulante sobre el Sistema Nervioso Central. El té, el café, el cacao y la yerba mate son algunos ejemplos de fuentes naturales a partir de donde podemos obtener cafeína. Las bebidas energizantes y la gaseosa de tipo cola mundialmente conocida también son fuente de este alcaloide. Una ingesta excesiva de cafeína puede producir angustia, irritabilidad, insomnio y temblores musculares, pudiendo llegar a ser tóxica para el organismo.
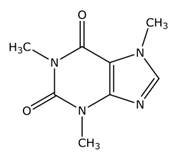
Figura 2: Estructura de la cafeína, cuyo nombre científico es 1,3,7-trimetilxantina
¿Podemos sublimar cafeína con los materiales de la caja?
En esta práctica desarrollaremos una técnica de sublimación a presión atmosférica para aislar cafeína a partir de hebras comerciales de té.
Con los materiales de la caja, armaremos el dispositivo de la Figura 3. En una cápsula de porcelana, colocaremos un puñado de hebras de té, de manera tal de cubrir aproximadamente la mitad del recipiente, que finalmente será colocado sobre la base de una fuente de calor, evitando el contacto directo (para ello, utilizaremos la malla metálica presente en la caja). Encenderemos la fuente de calor, procurando generar un calor suave, y cubriremos la cápsula de porcelana con un vidrio de reloj que contendrá cubos de hielo. Al cabo de unos minutos de calefacción, observaremos pequeños cristales de cafeína depositados sobre la base del vidrio de reloj. Como consecuencia del calor entregado, la cafeína en estado sólido presente en las hebras de té sublima y estos “vapores de cafeína” vuelven a solidificarse cuando chocan con la superficie fría de la base del vidrio de reloj.
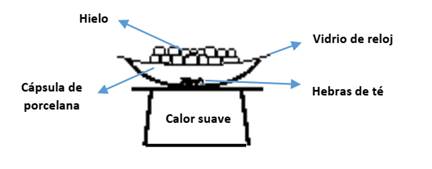
Figura 3: Dispositivo utilizado para la sublimación
BIBLIOGRAFÍA
- · Chang, R., Goldsby, K. A., Álvarez Manzo, R., y Ponce López, S. (2013). Química (11a. ed.). México D.F.: McGraw Hill.
- · Alsina, D., Cagnola, E., Güemes, R., Noseda, J. C. y Odetti, H. (2012). Química: conceptos fundamentales. Santa Fe: Ediciones UNL.
- · Kurman, L. G. (1990). Química Orgánica. Fundamentos teórico-prácticos del laboratorio. Buenos Aires: Eudeba.
- · Larpin, D. (2019). Aislamiento y purificación de cafeína. Guía de Trabajo Práctico de Química Orgánica. Facultad de Bioquímica y Ciencias Biológicas. Universidad Nacional del Litoral.
- · Vogel, A., Furniss, B., Hannaford, P., Smith, P. y Tatchell, A. (1989). Vogel's Textbook of Practical Organic Chemistry. New York: John Wiley.
- · Bruneton, Jean. (1991). Elementos de Fitoquímica y Farmacognosia. Zaragoza: Acribia.