EXPERIMENTANDO CON COMPRIMIDOS DE ASPIRINA
“La música pop es la aspirina y el blues son las vitaminas”
Peter Tork
¿Qué es la Aspirina?
Es un medicamento cuyo ingrediente farmacéutico activo es el ácido acetilsalicílico. Se utiliza principalmente como analgésico, antipirético y antiinflamatorio.
¿Cómo se descubrió?
Los antiguos Sumerios, hace unos 4000 años, empleaban cortezas de ciertos árboles (entre ellos el sauce), para curar los dolores. Alrededor del 400 A.C., Hipócrates recomendaba masticar corteza de sauce o realizar un té para aliviar el dolor, principalmente del parto. A mitad del siglo XVIII, Edward Stone realizó experimentos demostrando que la corteza de sauce triturada en forma de polvo molido podía curar la fiebre. Pasaron 70 años más, hasta que Johann Büchner identificó y purificó el compuesto responsable de esas propiedades farmacológicas: la salicina, sustancia amarillenta, cristalina y muy amarga. En ese entonces, los médicos ya la utilizaban rutinariamente para aliviar el dolor, la fiebre y la inflamación. El componente farmacológico de la salicina era el ácido salicílico (del latín: salix, sauce), el verdadero precursor de la aspirina.
En 1853, Charles Gerhardt fue quién logró sintetizar ácido acetilsalicílico, pero en una forma muy inestable e impura, que no despertó mayor interés. Por lo tanto, la investigación se centró en el mismo ácido salicílico aunque presentaba problemas al ser utilizado por su acidez, ya que provocaba irritación de las mucosas de la boca, del esófago y del estómago.
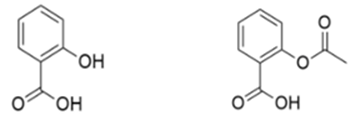
Figura 1: Estructuras químicas del ácido salicílico (izq.) y del ácido acetilsalicílico (der.).
Hubo muchos intentos por solucionar este inconveniente, hasta que finalmente, en 1897, la compañía farmacéutica Bayer, de la mano de Felix Hoffmann, encontró un nuevo método para obtener ácido acetilsalicílico y comenzó a comercializar el compuesto como un analgésico llamado aspirina (A, de “acetil”, y la raíz “spir” del nombre en latín de la ulmaria: Spirea, vegetal del que se extrae salicilato de metilo). Este fue reconocido ampliamente como uno de los primeros medicamentos farmacéuticos sintéticos.
¿Cómo funciona?
Después de una dosis individual de aspirina, una pequeña proporción se absorbe en el estómago, pero la mayor parte se absorbe más rápidamente en el intestino delgado superior. La aspirina así absorbida se hidroliza en el plasma, eritrocitos y, fundamentalmente hígado, a ácido salicílico que es el principio activo de la droga. Éste actúa principalmente en la inhibición de la producción de las prostaglandinas (sustancias mensajeras de la sensación del dolor), y de Interleucina-1, potente inductor de la inflamación de las zonas afectadas por traumatismos o enfermedades reumáticas. También alivia la fiebre debida a infecciones gracias a su acción dilatadora de vasos sanguíneos. Como antiagregante plaquetario inhibe la formación de trombos conformados por plaquetas y placas lipídicas que deterioran los vasos sanguíneos obstruyendo el normal flujo de la sangre, capaces de provocar accidentes cardiovasculares.
¿Cómo se obtiene?
La aspirina puede sintetizarse fácilmente por acetilación del ácido salicílico en presencia de un catalizador ácido. Luego debe purificarse y acondicionarse como corresponde para cumplir con lo establecido por el organismo regulador del país (ANMAT). La forma de presentación más común de la aspirina es el comprimido que contiene entre 500 y 650 mg de ácido acetilsalicílico mezclado con excipientes, que se utilizan para conseguir la forma farmacéutica deseada (cápsulas, comprimidos, soluciones, etc.) y facilitan la preparación, conservación y administración de los medicamentos. Generalmente para aspirina se utiliza aglomerante inerte (normalmente almidón y celulosa).
Si se desea purificar el ácido acetilsalicílico libre de estos excipientes se puede emplear el método de recristalización.
¿Qué es la recristalización?
Es un procedimiento útil para la purificación de sólidos cristalinos, que se fundamenta en la variación de la solubilidad de un sólido en un determinado solvente cuando varía la temperatura (Figura 2). La clave de este procedimiento radica en seleccionar un solvente tal que el sólido a purificar se disuelva muy bien a la temperatura de ebullición del solvente elegido pero muy poco en frío. Por ejemplo, la aspirina es muy soluble en etanol 96% a ebullición pero ligeramente soluble en etanol 96% a 5°C (temperatura del baño de hielo).
Otro aspecto clave a considerar son las impurezas que acompañan al sólido. Por un lado, hay impurezas que resultan ser insolubles a alta temperatura en el solvente elegido y deben ser retiradas mediante filtración en caliente para evitar que interfieran al recristalizar el sólido. Este es el caso del almidón y la microcelulosa cristalina presentes como excipientes en el comprimido de aspirina. Por otro lado, hay impurezas que permanecen disueltas en el solvente, aún en frío. Esto significa que al disolver el sólido con las impurezas en el solvente caliente, ambos se disuelven, pero al enfriar la solución resultante, el sólido cristaliza mientras que las impurezas permanecen disueltas. Por filtración logramos separar el sólido de sus impurezas: el compuesto cristalizado ahora puro y en fase sólida se retiene, mientras que las impurezas que lo acompañaban permanecen disueltas en la fase líquida.
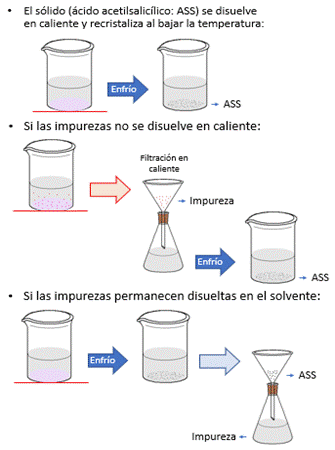
Figura 2: Pasos de la técnica de recristalización.
¿Cómo se realiza la recristalización de comprimidos de aspirina con el contenido de la caja?
La Figura 3 nos indica cómo podemos trabajar con los elementos de la caja. Pulverizar cuatro comprimidos de aspirina comercial en un mortero y conservar una mínima proporción del polvo obtenido para la prueba de Lugol. Transferir el material pulverizado a un vaso de precipitados de 250 mL de capacidad, con ayuda de una cucharita limpia y seca. Se agrega unos 20 mL de etanol 96% a ebullición (80°C) y se continúa calefaccionando con agitación hasta recuperar el hervor y asegurar que la aspirina se haya disuelto completamente. Los excipientes -celulosa microcristalina y almidón- no se disuelven. La mezcla sólido/líquido resultante se filtra. Los excipientes quedan retenidos en el papel de filtro. El filtrado, que es una solución etanólica de aspirina, se recoge en un Erlenmeyer de 250 mL. Se deja enfriar el Erlenmeyer a temperatura ambiente hasta observar la formación de cristales. Si se demorara la recristalización, colocarlo en baño de hielo agitando de vez en cuando. Por último, si se desea recuperar los cristales obtenidos, se realiza una segunda filtración utilizando, esta vez, un nuevo papel de filtro en el mismo embudo previamente lavado con alcohol de 96°. En el filtrado, recogido en un Erlenmeyer de 250mL, quedarán las aguas madres. Los cristales retenidos se lavan con dos porciones de 3 mL de etanol frío y se secan comprimiéndolos sobre papel de filtro. Una vez eliminada la mayor parte del solvente, se deja secar a temperatura ambiente y se procede a realizar la prueba de Lugol.

Figura 3:Pasos para la recristialización de comprimidos de aspirina.
Prueba de Lugol:
El reactivo de Lugol es una solución de yodo y yoduro de potasio disueltos en agua. El yodo reacciona con el almidón para dar un complejo azul-violeta fuerte. Esto permite que pueda emplearse para diferenciar la aspirina comercial, que contiene almidón entre sus excipientes, de la aspirina recristalizada, que está libre de esas impurezas. Para ello, se hierve en tubos de ensayo, una pequeña cantidad de cada muestra en 2 mL de agua, se deja enfriar y se añade una gota Lugol con el gotero. En nuestro caso, esperamos que el ensayo sea positivo para la aspirina comercial y negativo para la aspirina recristalizada.
BIBLIOGRAFÍA
- · Anderson Guarnizo, F. y Martínez Yepes, P. N. 2004. Experimentos de Química Orgánica: con enfoque en ciencias de la vida. Colombia: Ediciones Elizcom.
- · Blanco, A. 2002. Química Biológica Buenos Aires: Editorial El Ateneo.
- · Galagovsky Kurman, L. 1999. Química Orgánica: Fundamentos Teórico-Prácticos del Laboratorio. 6° Edición. Buenos Aires: Editorial Eudeba.
- · Perin, J. C. Guía de Trabajos Prácticos: Obtención de aspirina. Departamento de Química Orgánica. Facultad de Bioquímica y Ciencias Biológicas. Universidad Nacional del Litoral.
- · Zubrick, J. 1997. Organic chemistry laboratory survival manual: a student’s guide to techniques. 4° Edición. Nueva York: Editorial John Wiley.